Metainformationen zur Seite
Dies ist eine alte Version des Dokuments!
Das chemische Gleichgewicht
Das Stickstoffdioxid/Distickstofftetraoxidgleichgewicht
Darstellung von Stickstoffdioxid aus Bleinitrat
Wird Bleinitrat erhitzt, zerfällt es in Blei(II)oxid, Stickstoffdioxid und Sauerstoff gemäß: $$2Pb(NO_3)_{2(s)} \longrightarrow 2PbO_{(s)} + 4NO_{2(g)} + O_{2(g)}$$
Darstellung von Stickstoffdioxid aus Kupfer und halbkonzentrierter Salpetersäure
Bei der Reaktion von halbkonzentrierter Salpetersäure mit Kupfer entstehen Kupfer(II)nitrat $Cu(NO_3)_{2(s)}$, Stickstoffmonoxid $NO_{(g)}$ und Wasser $H_{2}O_{(l)}$. Das Stickstoffmonoxid $NO_{(g)}$ reagiert mit Luftsauerstoff weiter zu Stickstoffdioxid $NO_{2(g)}$.
Halbkonzentrierte Salpetersäure ist eine saure Lösung bestehend aus Hydroniumionen $H_3O^{+}_{(aq)}$.
$$(1) \space \space HNO_{3(aq)} + H_{2}O_{(l)} \rightleftharpoons H_3O^{+}_{(aq)} + NO_{3(aq)}^{-}$$
Kupfer(II)nitrat ist ein Salz der Salpetersäure. Die römische Zwei im Namen (II) gibt einen Hinweis darauf, welche Kupfer nach der Reaktion trägt.
$$(2) \space \space Cu_{(s)} \rightleftharpoons Cu^{2+}_{(aq)} + 2e^-$$
Die Oxidationzahl des Kupfers erhöht sich, das Kupfer wird zum Kupfer(II)-Ion oxidiert. Damit handelt es sich um eine Redoxreaktion.
Als Reaktionspartner verbleiben noch Hydroniumionen und die Nitrationen, die die Elektronen des Kupfers aufnehmen müssen. Als Produkte müssen Stickstoffmonoxid und Wasser gebildet werden (solche Gleichungen werden im Abitur im Material i.d.R. gegeben):
$$(3) \space \space 4H_3O^{+}_{(aq)} + 3e^- + NO_{3(aq)}^{-} \rightleftharpoons NO_{(g)} + 6H_{2}O_{(l)}$$
Überschüssiger Sauerstoff reagiert sehr oft mit Hydroniumionen zu Wasser. Jetzt müssen zunächst Elektronen ausgeglichen werden (Gleichung (2) mit 3 multiplizieren und Gleichung (3) mit 2 multiplizieren),
$$(2a) \space \space 3Cu_{(s)} \rightleftharpoons 3Cu^{2+}_{(aq)} + 6e^-$$ $$(3a) \space \space 8H_3O^{+}_{(aq)} + 6e^- + 2NO_{3(aq)}^{-} \rightleftharpoons 2NO_{(g)} + 12H_{2}O_{(l)}$$
Jetzt muss in Gleichung (1) noch die Anzahl an Hydroniumionen angepasst werden (mit 8 multiplizieren):
$$(1a) \space \space 8HNO_{3(aq)} + 8H_{2}O_{(l)} \rightleftharpoons 8H_3O^{+}_{(aq)} + 8NO_{3(aq)}^{-}$$
Wenn man jetzt Hydroniumionen, Wassermoleküle und Elektronen kürzt, ergibt sich:
$$Gesamt: 3Cu_{(s)} + 8HNO_{3(aq)} \rightleftharpoons 3Cu^{2+}_{(aq)} + 2NO_{(g)} + 6NO_{3(aq)}^{-} + 4H_{2}O_{(l)} $$
Das Stickstoffmonoxid reagiert mit Luftsauerstoff zu Stickstoffdioxid:
$$2NO{(g)} + O_{2(g)} \rightleftharpoons 2NO_{2(g)}$$
Besonderheiten des Stickstoffdioxids
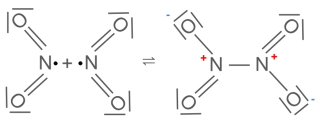
Stickstoffdioxid ist ein radikalisches Molekül:
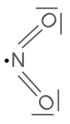
Es ist ein tiefbraunes Gas von chlorartigem Geruch. Du kannst vor allem im Winter in der Nähe von Dieselfahrzeugen seinen Geruch wahrnehmen, wenn deren Motor noch nicht warmgefahren ist, sodass die Stickoxide noch nicht vom Katalysator neutralisiert werden können.
Da Radikale sehr instabile Verbindungen sind mit dem Bestreben unter Verlust ihrer radikalischen Eigenschaften zu reagieren, verbinden sich einige Moleküle des Stickstoffdioxids zu farblosem Distickstofftetraoxid.
$$2NO_{2(g)} \rightleftharpoons N_{2}O_{4(g)} ; \Delta H_{r}^{0} = -57 \frac{kJ}{mol} $$