Inhaltsverzeichnis
Oxidationszahlen
Die Oxidationszahl ist ein Konzept zur Verallgemeinerung von Ionenladungen. Man schreibt auch in Molekülverbindungen allen Atomen eine fiktive Ionenladung zu, obwohl dort keine Ionenbindungen vorliegen.
Auch bei Reaktionen unter Beteiligung von Molekülverbindungen kann es zu einer Elektronenübertragung kommen. Durch das Konzept der Oxidationszahl kann bestimmt werden, welches Atom in einem Molekül formal Elektronen auf- oder abnimmt. Formal deswegen, weil die Elektronenauf- oder -abnahme real durch das gesamte Molekül erfolgt.
Regeln:
- Die Oxidationzahl im elementaren Zustand ist Null. Dies gilt sowohl für Atome als auch Elemente, die elementar als Molekül vorliegen (O2, N2, H2 …)
- Die Oxidationszahl eines einatomigen Ions ist gleich seiner Ionenladung.
- Die Summe der Oxidationszahlen aller Atome eines Molekülions ist gleich der Ladung dieses Ions.
- Die Summe der Oxidationszahlen aller Atome eines neutralen Moleküls ist Null.
- Fluor hat als elektronegativstes Element in allen Verbindungen die Oxidationszahl –I.
- Sauerstoff, das zweit-elektronegativste Element, hat meistens die Oxidationszahl –II. Ausnahmen liegen vor, wenn Sauerstoffatome miteinander verbunden (Peroxide) oder an Fluor gebunden sind: KO2, Na2O2, OF2
- Wasserstoff hat in Verbindungen mit Nichtmetallen die Oxidationszahl +I. In Metallhydriden (z.B. LiH, MgH2) hat Wasserstoff die Oxidationszahl –I.
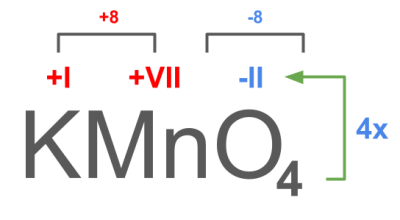
Beispiel Kaliumpermanganat
Kaliumpermanganat (KMnO4) ist eine gutes Beispiel, da mit Mangan ein Nebengruppenelement vorkommt, dessen Wertigkeit man nicht ohne Weiteres an der Gruppenzugehörigkeit erkennen kann. Die Oxidationszahl lässt sich aber indirekt durch die Elemente erschließen, deren Wertigkeit man kennt.
- Es steht in der Summenformel ein Metall (K: Kalium) vorne - daher handelt es sich um eine Ionenverbindung
- Kalium (K) steht in der ersten Hauptgruppe, In der ersten Hauptgruppe geben die Elemente ein Elektron ab, um eine Edelgaskonfiguration zu erreichen. Kalium liegt in einer Ionenverbindung als Kaliumion K+vor. Die Oxidationszahl von Kalium ist damit +I.
- Sauerstoff (O) steht in der sechsten Hauptgruppe. In der sechsten Hauptgruppe nehmen die Elemente zwei Elektronen auf, um eine Edelgaskonfiguration zu erreichen. Sauerstoff liegt in einer Ionenverbindung als Oxidion O2- vor. Die Oxidationszahl von Sauerstoff ist damit -II. In Kaliumpermanganat kommen vier Oxidionen vor mit jeweils der Oxidationszahl -II. Damit sind es insgesamt acht negative Ladungen.
- Mit einer positiven Ladung durch das Kaliumion und acht negativen Ladungen durch die Oxidionen, werden noch sieben positive Ladungen durch das Mangan-Ion benötigt, da das Molekül ja insgesamt neutral ist. Das Mangan-Ion ist als siebenfach positiv geladen (Mn7+). Die Oxidationszahl von Mangan ist damit +VII.
Beispiel Ethanol
Ethanol ist eine Molekülverbindung. Sehr oft werden Oxidationszahlen an der Oxidationsreihe der Alkohole diskutiert, weswegen sich Ethanol sehr gut für einen Einstieg handelt.
 Es sollen jetzt die Oxidationszahlen aller Atome im Ethanolmolekül bestimmt werden.
Es sollen jetzt die Oxidationszahlen aller Atome im Ethanolmolekül bestimmt werden.
Schritt 1
Zunächst werden alle Atomrümpfe mit den Elektronegativitätswerten der entsprechenden Elemente versehen:
 Jetzt ermittelt man eine formale Zugehörigkeit der jeweiligen Bindungselektronenpaare. Dabei gelten zwei einfache Regeln:
Jetzt ermittelt man eine formale Zugehörigkeit der jeweiligen Bindungselektronenpaare. Dabei gelten zwei einfache Regeln:
- Das Elektronenpaar gehört vollständig dem elektronegativeren Bindungspartner
- Sind die Elektronegativitätswerte beider Bindungsparter gleich, wird das Elektronenpaar geteilt
- Freie Elekronenpaare gehören immer vollständig dem Bindungspartner, bei dem sie stehen
Schritt 2
Man kennzeichnet durch Striche, welche Elektronen zu welchem Atomrumpf gehören. Der gelb markierte Bereich ist derjenige, der für viele Anwendungen der relevanteste ist.
 Jetzt kann man die Oxidationszahlen aller Atome durch Auszählen berechnen. Du kannst die Erklärungen für das jeweilige Atom ausklappen, damit du nicht hoch- und hinuterscrollen musst.
Jetzt kann man die Oxidationszahlen aller Atome durch Auszählen berechnen. Du kannst die Erklärungen für das jeweilige Atom ausklappen, damit du nicht hoch- und hinuterscrollen musst.
Das erste Kohlenstoffatom (links)
Das zweite Kohlenstoffatom (rechts)
Man sieht:
- Wasserstoff hat im Ethanol immer die Oxidationszahl +I, Sauerstoff die Oxidationszahl -II (vgl. Regeln für die Oxidationszahlen)
- Die Summe aller Oxidationszahlen im Molekül entspricht 0 (6x Wasserstoff +I, 1x Sauerstoff -II, 1x Kohlenstoff -III, 1x Kohlenstoff -I: 6*1+(-2)+(-3)+(-1) = 0), Ethanol ist ein neutrales Molekül.
Übungen
Aufgabe 1
Bestimme die Oxidationszahlen aller Atome im Chromation (CrO42-). Achte drauf, dass das Chromation zweifach negativ geladen ist.
Aufgabe 2
Bestimme die Oxidationszahlen aller Atome im Ethanalmolekül.
 Prüfe im Anschluss durch Zusammenrechnen aller Oxidationszahlen, ob deine Lösung stimmt.
Prüfe im Anschluss durch Zusammenrechnen aller Oxidationszahlen, ob deine Lösung stimmt.